目 录
一、项目特色
1、辉瑞重磅炸弹产品,销售保持高速持续增长
2、发病率高,国内患病人数超亿
3、塞来昔布属于一线用药,临床效果明确,地位稳固
4、具备技术门槛,阻挡竞争者
二、项目背景
1、原研产品情况介绍
2、适应症
3、药理特点
三、国内上市情况
1、进口药品
2、国产药品
四、市场情况
1、市场特色
2. 市场容量
3. 竞争产品分析
1)骨关节炎(OA)的药物治疗方案
2)类风湿关节炎(RA)的药物治疗治疗方案
3)关于COX-2类心血管风险问题
4.市场数据
1)全球销售情况:
2)国内销售情况:
3)国内涉及昔布类的生产厂家较少,外企占优势
5、销售预测
五、知识产权分析
六、产业化进程
1、原料药
1)工艺路线:
2)质量控制
3)完成产业化研究,完成项目申报
2、制剂:
1)处方工艺
2)一致性研究
3)稳定性研究
七、合作方式
一、项目特色
1、辉瑞重磅炸弹产品,销售保持高速持续增长
全球销售情况:作为辉瑞的重磅产品,西乐葆2010年全球市场销售额近30亿美元。环比增长10%。
国内销售情况:近年来塞来昔布在国内市场保持稳定增长,2009年全国销售金额超6亿元,环比增长保持在30%左右。
仿制品上市后可以采取跟随策略,可大大减小市场推广费用,获得更高利润率。
2、发病率高,国内患病人数超亿
骨关节炎是最常见的关节疾病,尤其危害老年人健康。据WHO调查,目前全球关节病患者已超过4亿人。我国关节炎患者超过人口总数的10%,人数远超1亿,且发病率随年龄增长而升高。截至2015年,估计中国大陆关节炎患者有1亿人以上,而且人数还在不断增加。
3、塞来昔布属于一线用药,临床效果明确,地位稳固
塞来昔布所属的NSAIDs类在骨关节炎的药物治疗方案、类风湿关节炎(RA)的药物治疗方案的一线方案中,在临床已被广泛接受。
①骨关节炎的药物治疗方案:
非选择性NSAIDs胃肠道不良反应较高,临床使用受限制。在权衡患者胃肠道、肝、肾、心血管疾病风险后,可选用塞来昔布等选择性COX-2抑制剂。
②类风湿关节炎(RA)的药物治疗:RA的药物治疗通常包括NSAIDs、抗风湿药(DMARDs)和/或糖皮质激素。塞来昔布所属的NSAIDs类在RA的初始治疗及后续治疗方案中。
4、具备技术门槛,阻挡竞争者
原料工艺工艺路线第二步为关环反应,影响收率,此外还涉及晶型研究及杂质研究和杂质的制取。
塞来昔布胶囊属于大规格水不溶品种,并有原研产品专利对关键工艺即小颗粒工艺进行了保护,技术门槛较高,从技术高度上阻挡了部分后续竞争者。
本项目采用的技术,成功规避了原研专利,在收率、晶型、稳定性等技术关键点上获得了较理想的结果。
二、项目背景
1、原研产品情况介绍
1998年,辉瑞/Pharmacia开发的Celebrex(塞来昔布胶囊,商品名西乐葆)以优先审评的方式获得FDA批准上市。
目前国内唯一上市产品是从美国辉瑞公司进口。作为辉瑞的重磅产品,西乐葆2010年全球市场销售额近30亿美元。
市售品规格:100mg/粒,200mg/粒。
2、适应症
塞来昔布是国内外用于治疗骨关节炎及类风湿类疼痛首选药物之一;
适应症如下:(1)用于缓解骨关节炎症状和体征。(2)用于缓解成人类风湿关节炎的症状和体征。
3、药理特点
塞来昔布具有独特的作用机制即特异性地抑制环氧化酶-2(COX-2)。炎症刺激可诱导COX-2生成,因而导致炎性前列腺素类物质的合成和聚积,尤其是前列腺素E2,引起炎症、水肿和疼痛。塞来昔布可通过抑制COX-2阻止炎性前列腺素类物质的产生,达到抗炎、镇痛及退热作用。
三、国内上市、注册情况
1、进口药品
辉瑞的塞来昔布原料、胶囊(0.1g、0.2g)已在国内上市。
2、国产药品
(1)原料:江苏盛迪医药有限公司、江苏正大清江制药有限公司,2家获得原料批件。
(2)制剂:尚无国内厂家获得制剂批件。
3、国内注册情况

四、市场情况
塞来昔布是国内外用于治疗风湿及类风湿类疼痛首选药物,目前国内唯一上市产品是从美国辉瑞公司进口。该产品2010年国际市场销售额近30亿美元。
1、市场特色
(1) 临床效果明确,进入指南用药,临床教育充分。
(2) 日均费用较高,医保产品,利润空间大。
2. 市场容量
骨关节炎(OA)以中老年患者多见,女性多于男性。60岁以上的人群中患病率可达50% ,75岁以上的人群中则达80%。据IMS数据,我国骨关节炎患者6500万人。类风湿性关节炎(RA),在我国的患病率约3‰,患者数4500万人。
3. 竞争产品分析
1)骨关节炎(OA)的药物治疗方案
——塞来昔布所属的NSAIDs类在临床指南方案中。
骨关节炎是指由多种因素引起关节软骨纤维化、皲裂、溃疡、脱失而导致的关节疾病。可根据关节疼痛情况选择全身镇痛药物治疗,常用的口服药物治疗方案如下:
OA患者临床常用药品比较,可以看出,塞来昔布用药金额高,利润空间大:
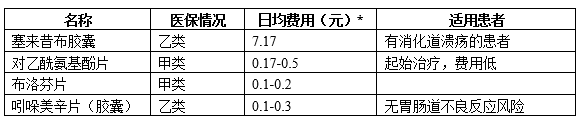
注*:除塞来昔布外,其他药品日均费用按国产普通口服制剂的零售价计算。
从受访医院的用药情况看,与临床指南推荐方案一致。塞来昔布适用于有胃肠道风险的骨关节炎患者。
2)类风湿关节炎(RA)的药物治疗治疗方案
——塞来昔布所属的NSAIDs类在一线方案中
类风湿性关节炎是一种以对称性多关节炎为主要临床表现的自身免疫性疾病,以关节滑膜慢性炎症、关节的进行性破坏为特征。RA的药物治疗通常包括NSAIDs、抗风湿药(DMARDs)和/或糖皮质激素。常用的口服制剂方案如下:
|
|
|
3)关于COX-2类心血管风险问题
——风险可控,不是用药障碍。
就塞来昔布心血管风险的问题,我们咨询了一线临床专家,受访医生对于COX-2类心血管风险的看法如下:
①塞来昔布心血管风险的病例报道是治疗肠息肉的患者,属于长期服药,用药1年以上。
②用于风湿性关节炎、类风湿性关节炎主要用于止痛,用药周期由2周到1-2个月不等,用药时间短,心血管风险不大。
③用药前会评估患者心血管情况,可避免心血管系统不良反应的风险。
综上,在风湿免疫科医生看来,COX-2类心血管风险没有形成用药的障碍。
FDA要求辉瑞开展的PRECISION研究(Prospective Randomized Evaluation of Celebrex Integrated Safety vs.
Ibuprofen or Naproxen),评估塞来昔布、布洛芬、萘普生的安全性。
2016年,《新英格兰医学杂志》发表的PRECISION研究结果显示,与布洛芬及萘普生相比,塞来昔布的主要不良心血管事件、心血管死亡、全因死亡发生风险无显著差异。塞来昔布组有188例(2.3%)心血管死亡患者,萘普生组为201例(2.5%),布洛芬组为218例(2.7%)。
在安全性这一次要终点上,塞来昔布的胃肠道不良反应低于布洛芬和萘普生并不意外,而且严重肾脏不良事件和高血压导致住院的发生率显著低于布洛芬。
4.市场数据
1)全球销售情况:
2004年西乐葆全球销售额曾达33亿美元,其后出现罗非昔布全球被召回事件,令销售额下降接近50%。据全球畅销药数据,辉瑞塞来昔布销售额由2004年的33.02亿美元下降至2005年的17.3亿美元,2011年逐步恢复到29.2亿美元,2013年全年销售29.18亿美元。近几年销售额逐步回升,并稳定在30亿美元左右。
受罗非昔布全球被召回事件影响,作为同是COX-2抑制剂的塞来昔布被怀疑长期用药会带来心血管风险增高。辉瑞开展了知名的PRECISION研究,入组24081例确定患有心血管疾病或心血管疾病风险因素评分较高的骨关节炎或类风湿性关节炎患者。
2016年11月13日,Nissen教授在AHA2016大会上为大家揭晓了同步发表于《新英格兰医学杂志》上的PRECISION研究的结果。与布洛芬及萘普生相比,塞来昔布的主要不良心血管事件、心血管死亡、全因死亡发生风险无显著差异。塞来昔布组有188例(2.3%)心血管死亡患者,萘普生组为201例(2.5%),布洛芬组为218例(2.7%)。
这一研究结果将给塞来昔布未来国内外市场销售带来深远影响。
2)国内销售情况:
国内塞来昔布市场规模从2005年的2268万元增长到2015年的1.6亿元,2005-2015年复合增长率为21.7%,该产品自上市以来保持较高的增长速度
|
|
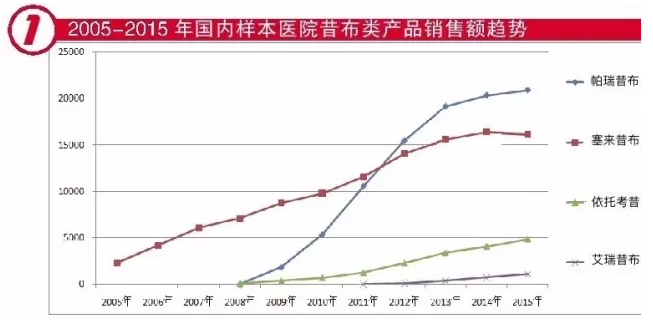
国内有许多厂家进行了申报,但由于受审评进度影响,至今国内尚无仿制药上市。在2016年国内通过集中审评模式批准了很多批件,但是由于受一致性评价政策的影响,这些批件基本都是一纸空文。可以遇见,国内仿制药将会在多年内无法上市。
3)国内涉及昔布类的生产厂家较少,外企占优势
国内销售额排名前五位企业分别是:法玛西亚公司的帕瑞昔布,销售额2.1亿元;辉瑞制药的塞来昔布,销售额1.6亿元;默沙东公司的依托昔布,销售额4851万元;江苏恒瑞公司的艾瑞昔布,销售额1095万元。
目前,国内涉及昔布类的生产厂家较少,外资企业占97.5%份额,国内企业占2.5%份额。预计专利限制到期后,国产品份额将大幅增长。
5、销售预测
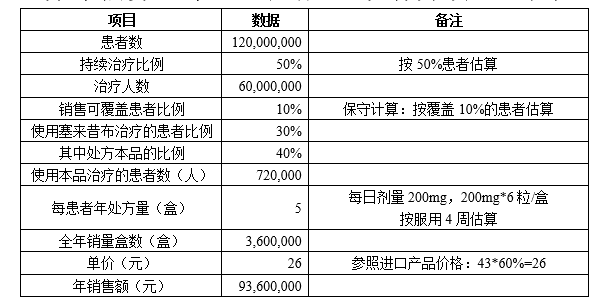
保守估算,本品达产后,年销售额可近亿元。详情如下表:
五、知识产权分析
辉瑞公司对该产品申请了包括化合物、合成工艺、晶型、制剂、剂量及粒径等产品专利,本项目不对原研专利构成侵权。
本公司开发的塞来昔布项目拥有独立知识产权,原料药和制剂均申请了国家发明专利,并均已获得专利授权。
六、产业化进程
1、原料药
1)工艺路线:
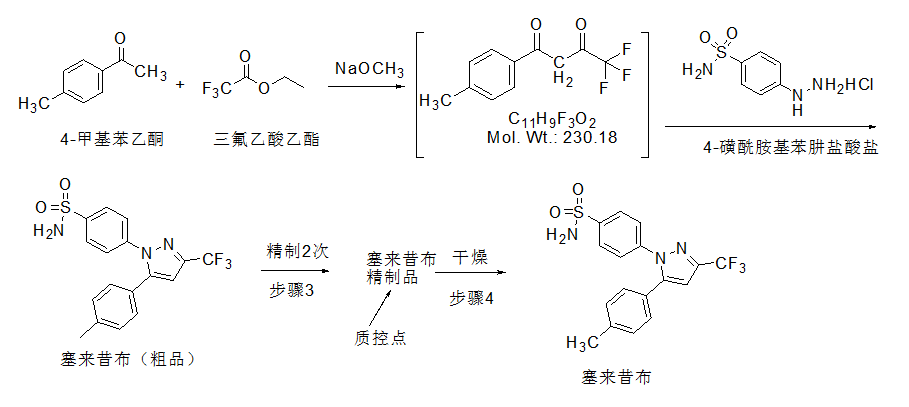
塞来昔布制备:是以4-甲基苯乙酮为起始物料,在甲醇钠作用下与三氟乙酸乙酯进行Claisen缩合,得到中间体:1-(4-甲基苯基)-4,4,4-三氟-1,3-丁二酮;中间体在酸性条件下与4-磺酰胺基苯肼盐酸盐缩合关环制备塞来昔布粗品;经活性炭脱色后重结晶两次得到塞来昔布精制品;经干燥得到塞来昔布。各反应机理简单清楚,工艺稳定。总收率~70%。与已有工艺相比,总能耗减少约3/4,收率提高一倍,生产周期缩短3/4。生产成本仅为已有工艺一半。
2)质量控制
完成分析方法开发;完成杂质谱研究和分析方法验证。
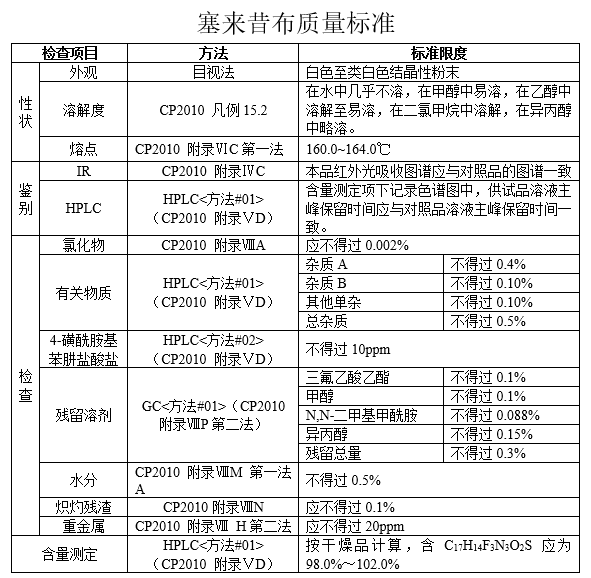
目前,塞来昔布的质量标准在欧洲药典及美国药典中均有收载。在本品质量研究的前期,仅在美国药典论坛[USP-PF36(6)]及欧洲药典论坛(PHARMEUROPA 22.4)中公布了本品的质量标准意见稿。本品的质量标准是参考EP、USP、进口注册标准JX20050041和相关技术指导原则,同时结合本品的合成工艺及质量研究的结果制定。如下表所示:
3)完成产业化研究,完成项目申报
样品检验报数据
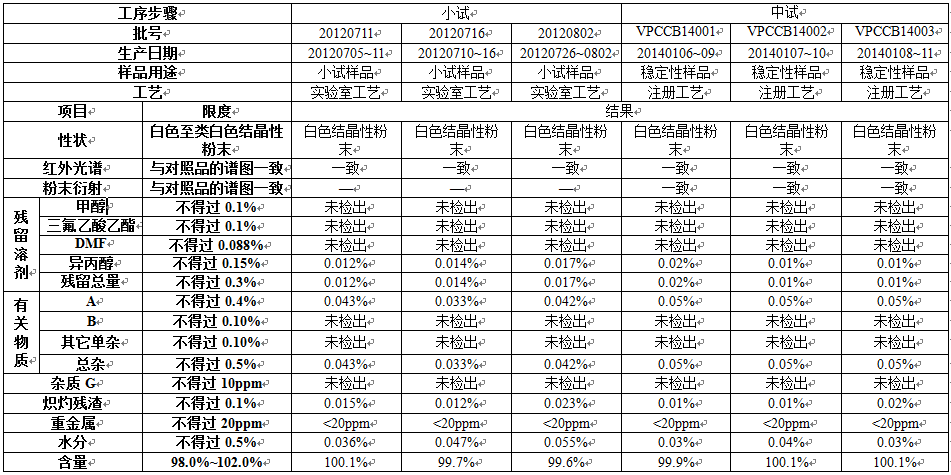
本项目的原料药,已于2015年在烟台外润药业有限公司申报,已审评完毕,待发批件。

2、制剂:
按新法规化药新4类要求,在完成BE后、提交生产申报。
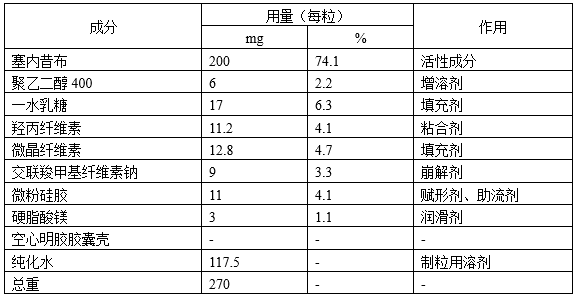
1)处方工艺
2)一致性研究
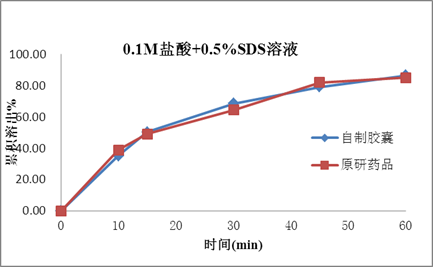
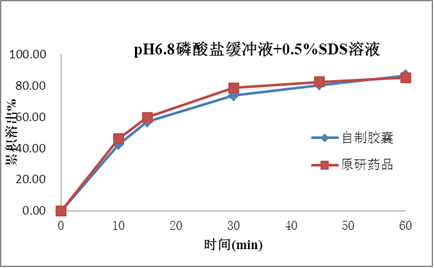
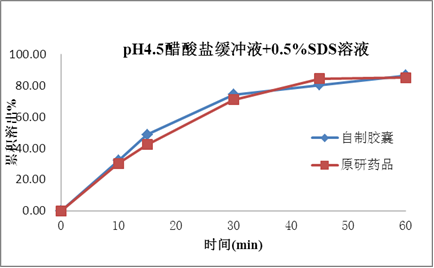
塞内昔布为难溶性,在药物吸收的常规胃肠道pH值范围(pH1.0~7.5)的水溶液中几乎都不溶解,BCS分类为2类。药物的溶出是药物吸收和生物等效的关键技术参数,如何提高药物的溶出是本品处方研究的重点。
处方研究聚焦于对各种增溶方式的深入广泛研究,如原辅料粒径、各辅料种类和用量,特别是增溶剂的种类和用量的处方筛选;确保产品的溶出和原研一致,进而确保本品和原研品的生物等效性。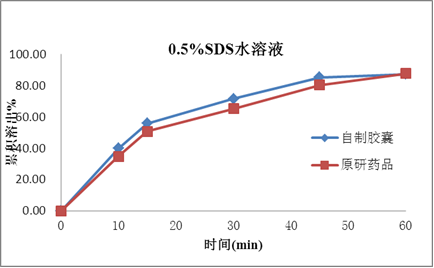
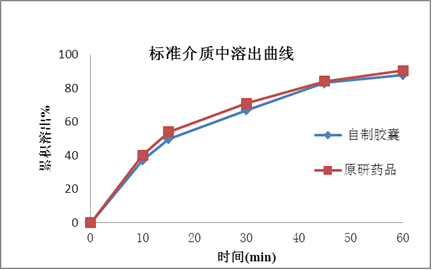
3)稳定性研究
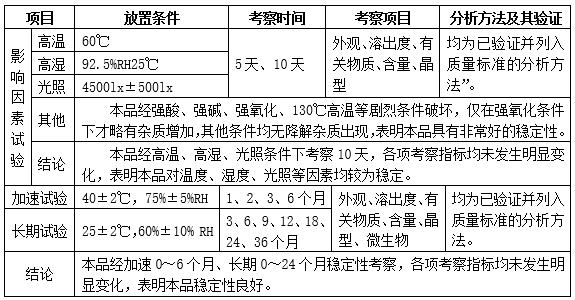
完成杂质谱研究,分析方法开发和验证,制定了本品的质量标准,不低于目前法规申报要求,不低于进口注册标准;完成稳定性研究。
七、合作方式
技术开发与转让。
本公司拥有本项目开发的自主知识产权,且已获专利授权;拥有本项目原料及制剂成熟工艺技术,且拥有向药品审评中心申报经验,了解该项目注册申报的技术要求与申报要点,现欲对本项目进行技术转让。